Comparación FC entre Jivi y Eloctate
Haga clic para expandir la sección.
Los niveles del rFVIII Jivi® permanecen elevados y sostenidos a lo largo del tiempo
- Se investigó la farmacocinética (FC) de Jivi® en 29 pacientes con hemofilia A grave (≥12 años de edad) después de una dosis única de 60 UI/kg
- La farmacocinética es la actividad de los fármacos en el organismo durante un período de tiempo
La FC se midió principalmente mediante*
Jivi® es un rFVIII PEGilado con una vida media extendida§ de 17.9 horas†

UI, unidades internacionales; kg, kilogramos; PEG, polietilenglicol; rFVIII, factor VIII recombinante.
Otros parámetros FC medidos fueron la concentración máxima del fármaco en el plasma después de una dosis única, la media del tiempo de permanencia después de una administración IV y la distribución del volumen aparente en estado de equilibrio.
Depuración medida 1.63 mL/h/kg.
Área bajo la curva medida 4060 UI*h/dL.
La vida media se define como el tiempo que tarda la cantidad de un fármaco en la sangre en reducirse a la mitad.
†Con una dosis única de 60 UI/kg.
Escuche por qué Venkat sabía que quería un producto de factor VIII con una vida media extendida.
Comparación FC de Jivi® y Eloctate®
Comparación FC de Jivi® y Eloctate®
En los 17 pacientes (sin contar al que presentó valores atípicos), hubo 3 diferencias de FC estadísticamente significativas:
En comparación con Eloctate®
Jivi® demostró más tiempo antes de alcanzar los niveles mínimos de FVIII
Mediana del tiempo de Jivi® para alcanzar los niveles mínimos de FVIII (en comparación con Eloctate® ) en un análisis FC poblacional (sin incluir al paciente atípico, N=17)§
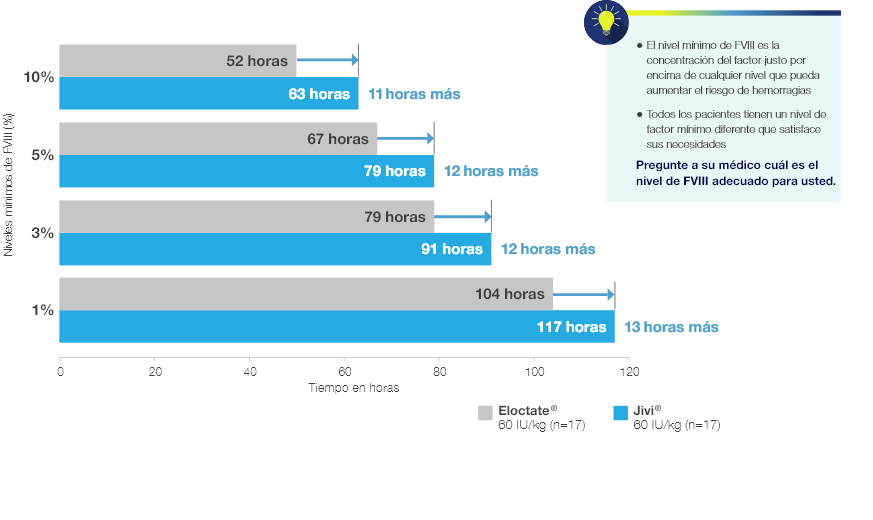
FC, farmacocinética; FVIII, factor VIII.
*Jivi® mostró un área bajo la curva media más alta (+25%).
†Jivi® presentó una depuración media más baja (-20%).
‡Jivi® tuvo vida media más prolongada (+7%).
§Adaptado de Shah et al. Se desarrolló un modelo de FC poblacional basado en los datos obtenidos de un ensayo de una sola etapa para simular el tiempo hasta alcanzar umbrales de FVIII de 1, 3, 5 y 10% de FVIII.
En comparación con Eloctate®, Jivi® demostró estas características estadísticamente significativas (N=17):
![[vacío] Imagen que resume datos FC de Jivi](/sites/g/files/vrxlpx55361/files/2024-01/eloctate-resumen-desktop_0.png)
Para N=18 pacientes, incluido el paciente con FC atípica, Jivi® demostró una no inferioridad respecto de Eloctate® para el ABC (0-t última)*
Consulte con su médico si la cobertura farmacocinética de Jivi® es adecuada para usted.
FC, farmacocinética; FVIII, factor VIII.
*Jivi® mostró un área bajo la curva media más alta (+25%).
†Jivi® presentó una depuración media más baja (-20%).
‡Jivi® tuvo vida media más prolongada (+7%).
§10%: 63 horas para Jivi® frente a 52 horas para Eloctate®; 5% 79 horas para Jivi® frente a 67 horas para Eloctate®;
3%: 91 horas para Jivi® frente a 79 horas para Eloctate®; 1% 117 horas para Jivi® frente a 104 horas para Eloctate®.
FC, farmacocinética
INDICACIONES
JIVI es un medicamento inyectable que se utiliza para reemplazar el factor de coagulación (Factor VIII o factor antihemofílico) que no poseen las personas que padecen hemofilia A.
JIVI se utiliza para tratar y controlar las hemorragias en adultos y niños, a partir de los de 7 años de edad, con hemofilia A que recibieron tratamiento previamente. Su proveedor de atención médica también puede administrarle JIVI cuando se somete a una cirugía. JIVI puede reducir la cantidad de episodios de hemorragia en adultos y niños, a partir de los de 7 años de edad, con hemofilia A si se usa de manera regular (profilaxis).
JIVI no está indicado para usar en niños menores de 7 años o en pacientes que no recibieron tratamiento previo.
JIVI no está indicado para tratar la enfermedad de von Willebrand.
INFORMACIÓN DE SEGURIDAD IMPORTANTE
No debe utilizar JIVI si es alérgico a los roedores (como los ratones y hámsteres) o a cualquier ingrediente de JIVI.
JIVI puede provocar reacciones alérgicas. Llame a su proveedor de atención médica de inmediato e interrumpa el tratamiento si presenta opresión en el pecho o la garganta, mareos, disminución en la presión arterial o náusea. Es posible que ocurran reacciones alérgicas al polietilenglicol (PEG), un componente de JIVI.
Su cuerpo también puede fabricar anticuerpos, denominados “inhibidores”, contra JIVI o ciertos componentes de JIVI, como el polietilenglicol (PEG), lo que puede interrumpir la acción adecuada de JIVI. Consulte con su proveedor de atención médica para asegurarse de que será supervisado atentamente mediante análisis de sangre para detectar el desarrollo de inhibidores del Factor VIII. Informe a su proveedor de atención médica si le han informado que tiene inhibidores del Factor VIII.
Si su hemorragia no es controlada con su dosis habitual de JIVI, consulte con su médico de inmediato. Puede haber desarrollado inhibidores del Factor VIII o anticuerpos contra el PEG y su médico puede realizar pruebas para confirmarlo.
Los efectos secundarios frecuentes de JIVI son dolor de cabeza, fiebre, tos y dolor abdominal.
Estos no constituyen todos los posibles efectos secundarios de JIVI. Informe a su proveedor de atención médica acerca de cualquier efecto secundario que le moleste o no desaparezca.
Informe a su proveedor de atención médica sobre todas las enfermedades y/o condiciones médicas que tiene o que tuvo.
Para obtener información adicional importante sobre riesgos y uso, consulte la Información para Prescribir completa.
References: Anderson PL. The ABCs of pharmacokinetics. http://www.thebody.com/content/art875.html. Accessed April 2018. • Collins PW, Blanchette VS, Fischer K, et al. Break-through bleeding in relation to predicted factor VIII levels in patients receiving prophylactic treatment for severe hemophilia A. J Thromb Haemost. 2009;7(3):413-420. • Data on file. 2.5 Clinical Overview. Bayer; 2017. • Data on file. Tx Review 1018. Bayer; 2018. • Dhillon S, Gill K. Basic pharmacokinetics. In: Dhillon S, Kostrzewski A, eds. Clinical Pharmacokinetics. London, UK: Pharmaceutical Press; 2006. • Ivens IA, Baumann A, McDonald TA, Humphries TJ, Michaels LA, Mathew P. PEGylated therapeutic proteins for haemophilia treatment: a review for haemophilia caregivers. Haemophilia. 2013;19(1):11-20. • Jivi® Prescribing Information. Whippany, NJ: Bayer LLC; 2018. • Ratain MJ, Plunkett WK Jr. Principles of pharmacokinetics. In: Kufe DW, Pollock RE, Weichselbaum RR, et al, eds. Holland-Frei Cancer Medicine. 6th ed. Hamilton, Ontario: BC Decker, Inc; 2003. • Shah A, Solms A, Wiegmann S, et al. Direct comparison of two extended-half-life recombinant FVIII products: a randomized, crossover pharmacokinetic study in patients with severe hemophilia A. Ann Hematol. 2019;1-10. https://link.springer.com/article/10.1007%2Fs00277-019-03747-2. Published June 24, 2019. Accessed June 25, 2019. • Veronese FM, Mero A. The impact of PEGylation on biological therapies. BioDrugs. 2008;22(5):315-329. • Webster R, Elliot V, Park BK, Walker D, Hankin M, Taupin P. PEG and PEG conjugates toxicity: towards an understanding of the toxicity of PEG and its relevance to PEGylated biologicals. In: Veronese FM, ed. PEGylated Protein Drugs: Basic Science and Clinical Applications. Basel, Switzerland: Birkhäuser Verlag/Switzerland; 2009:127-146.





