90%
de las hemorragias se resolvieron
con ≤2 infusiones1*†‡
INFORMACIÓN DE SEGURIDAD IMPORTANTE SELECCIONADA: No debe utilizar JIVI si es alérgico a los roedores (como los ratones y hámsteres) o a cualquier ingrediente de JIVI. SIGA LEYENDO A CONTINUACIÓN
Haga clic para expandir la sección.
La dosis de Jivi se adaptó a las tendencias de hemorragia de los pacientes4
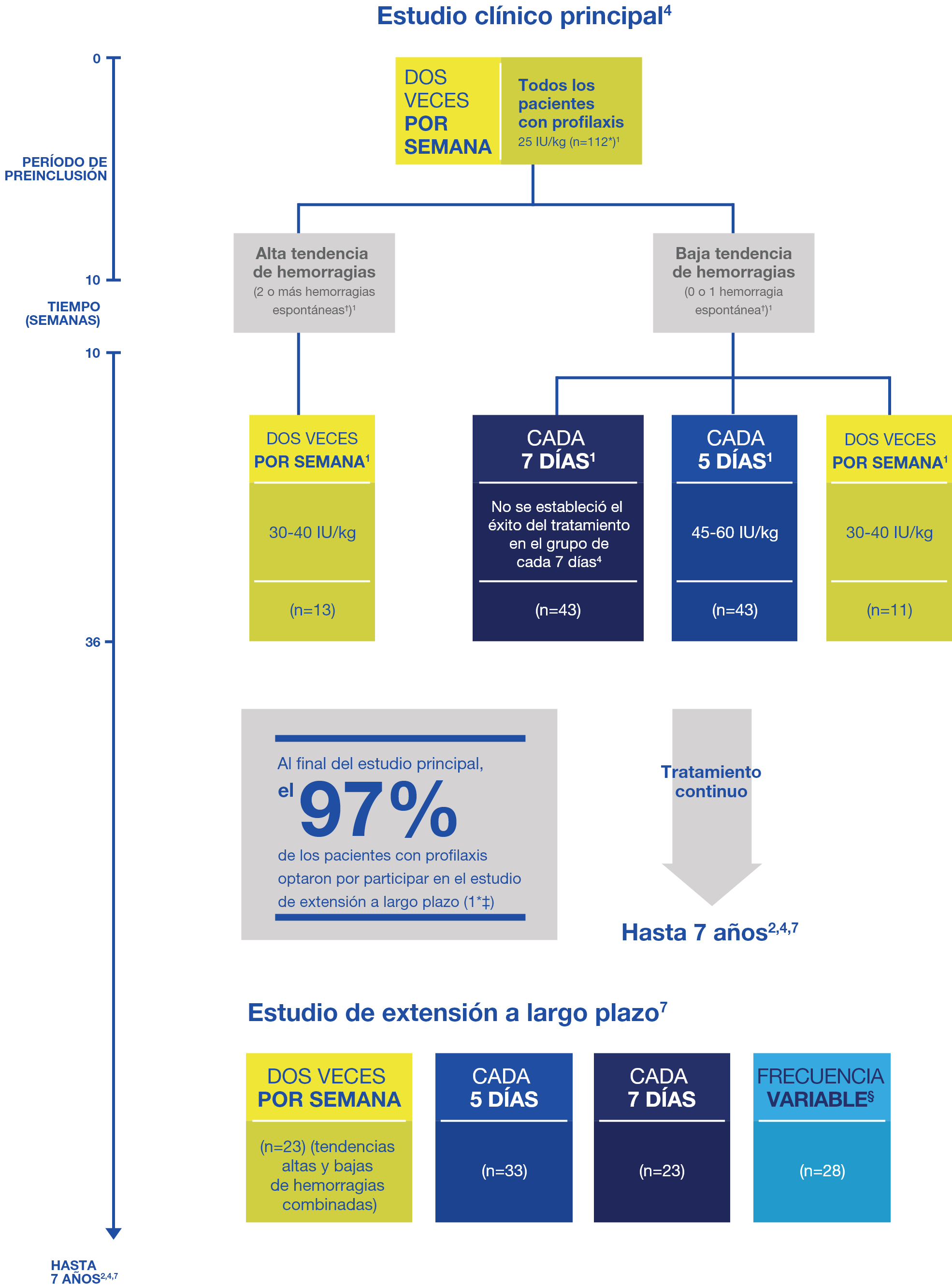
UI: unidades internacionales; kg: kilogramos.
*112 pacientes ingresaron a los grupos de tratamiento profiláctico; otros 20 pacientes ingresaron a un grupo de control de tratamiento a demanda. Dos pacientes que estaban en los grupos de tratamiento profiláctico abandonaron el estudio de forma prematura durante el período de preinclusión.1
†Definidos como sangrados articulares o musculares y sin traumatismos identificados.1,4
‡121 de 134 pacientes incluidos en el estudio PROTECT VIII principal pasaron al estudio de extensión y recibieron tratamiento a demanda (n=14) o profilaxis (n=107).7
§Los pacientes que cambiaron la frecuencia de la dosis al menos una vez después de la primera semana del estudio de extensión se analizaron en un grupo de frecuencia variable separado.7
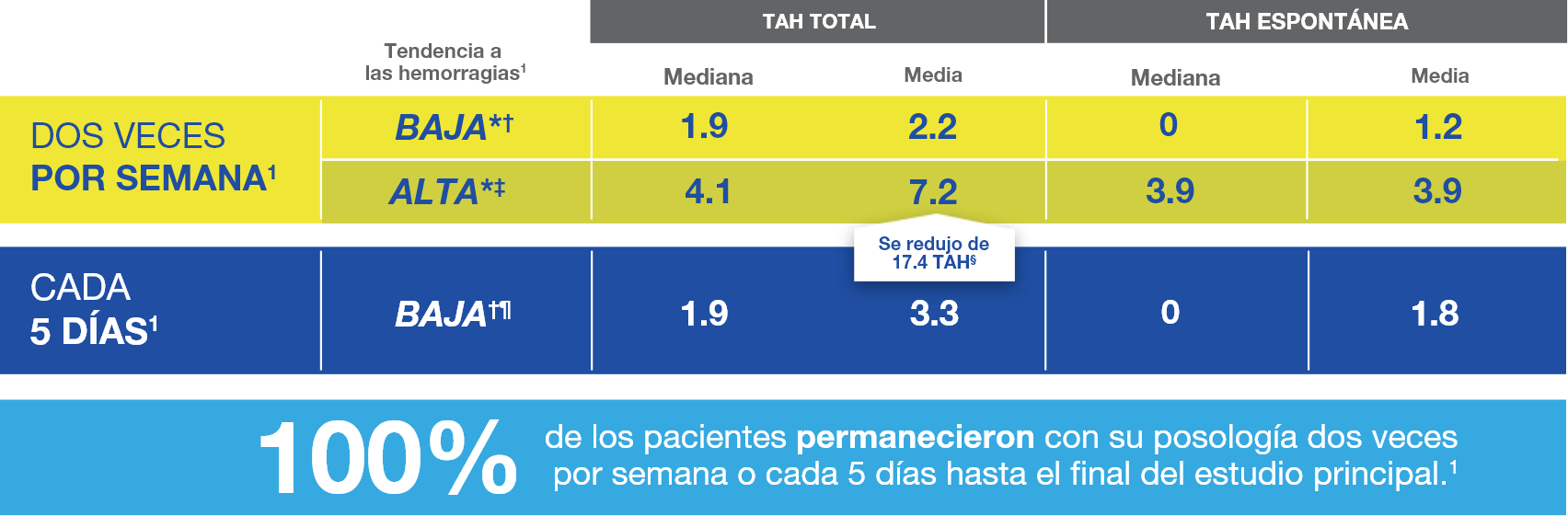
Reducción del 88.2 % en la TAH frente al tratamiento a demanda.1
TAH (Tasa anualizada de hemorragia).
*n=11; n=13 (dos veces por semana: baja; alta).1
†Pacientes con 0 o 1 hemorragia espontánea (definida como una articulación blanco o muscular y sin traumas identificados) durante las semanas 1-10 del estudio principal.1,4
‡Pacientes con 2 o más hemorragias espontáneas (definida como una articulación blanco o muscular y sin traumas identificados) durante las semanas 1-10 del estudio principal.1,4
§Nueve de los 13 sujetos de este grupo estuvieron en tratamiento profiláctico previo y se observó que tenían una media de 17.4 hemorragias en los 12 meses anteriores al ingreso al estudio.1
¶n=43 (cada 5 días).1
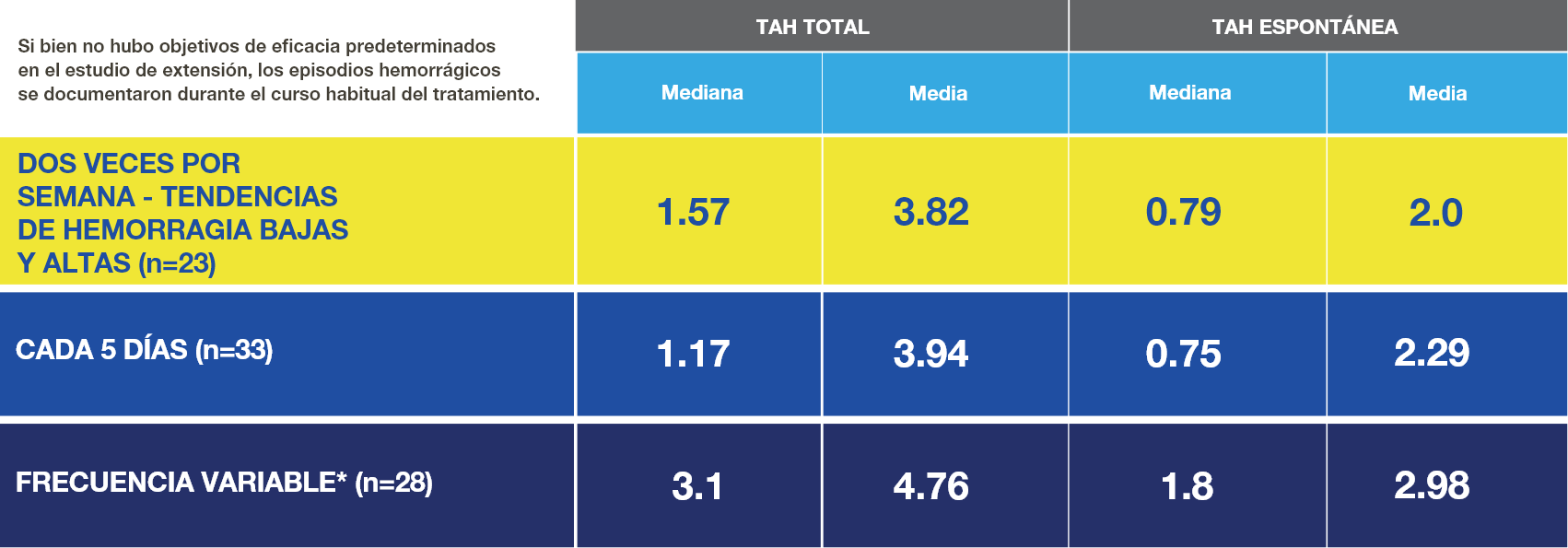
*Los pacientes que cambiaron la frecuencia de dosificación al menos una vez después de la primera semana del estudio de extensión se analizaron en un grupo de frecuencia variable distinto.7
TAH (Tasa anualizada de hemorragia).
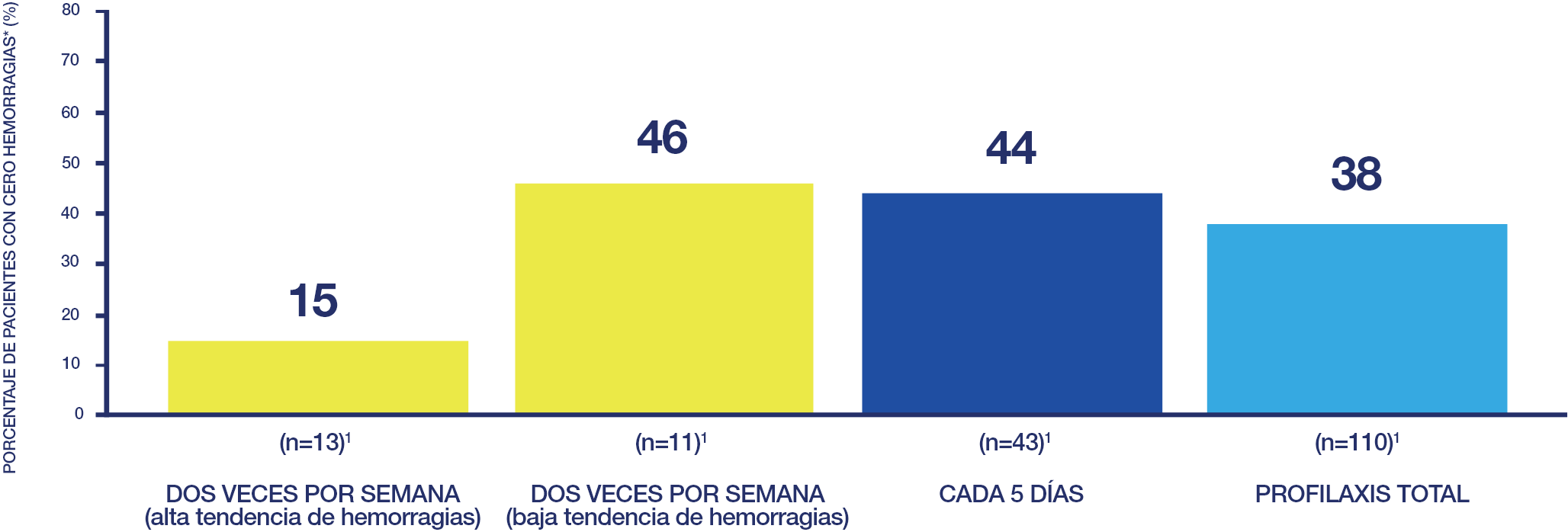
*El total de hemorragias incluye las hemorragias espontáneas, las hemorragias por traumatismo y las articulaciones blanco.
90%
de las hemorragias se resolvieron
con ≤2 infusiones1*†‡
83%
1 infusión
7%
2 infusiones
10%
≥3 infusiones
*n=112 con profilaxis.1
†Tratamiento de las hemorragias desde la semana 0 hasta la semana 36.1
‡Dos pacientes suspendieron el tratamiento después de una dosis única de Jivi y no se incluyeron en el análisis de eficacia.1
Escuche a Venkat, un paciente de Jivi, compartir su punto de vista sobre la protección contra hemorragias que brinda Jivi.
Resultados de 82 pacientes que estaban en el grupo de profilaxis en el estudio principal y que continuaron en el estudio de extensión.† (mediana de tiempo: 1421 días [intervalo: 700-2071]9).

95%
de las articulaciones blanco históricas* se resolvieron9†
107 de 113 articulaciones blanco históricas se resolvieron para el momento del análisis (corte de datos 8/28/2019)9
La mediana de la TAH en articulaciones blanco fue de 0 al final del estudio principal y de 0 en la fecha de corte del estudio de extensión (8/28/2019)9
La media de la TAH en articulaciones blanco fue de 1.28 al final del estudio principal y de 1.06 en la fecha de corte del estudio de extensión (8/28/2019)12
El análisis consistió en9:

91%
de las articulaciones blanco históricas o nuevas* se resolvieron9†
111 de 122 articulaciones blanco históricas o nuevas se resolvieron para el momento del análisis (corte de datos 8/28/2019)9
La mediana de la TAH en articulaciones blanco fue de 0 al final del estudio principal y de 0 en la fecha de corte del estudio de extensión (8/28/2019)9
La media de la TAH en articulaciones blanco fue de 1.28 al final del estudio principal y de 1.06 en la fecha de corte del estudio de extensión (8/28/2019)12
El análisis consistió en9:
*Pacientes que se mantuvieron en el mismo plan profiláctico durante los últimos 90 días de tratamiento. La mediana de la TAH (Tasa anualizada de hemorragia), para las articulaciones blanco fue de 0.00 para la posología de dos veces por semana y de 0.00 para el intervalo de tratamiento cada 5 días.10
†Tal como definió la Sociedad Internacional de Trombosis y Hemostasia (ISTH).9
Hasta 7 años de datos de seguridad en pacientes de 12 años o más previamente tratados4,7
Dolor de cabeza, Tos, Náuseas, Fiebre
Ocurrieron eventos adversos graves relacionados con el medicamento en 2 pacientes en el estudio de extensión y 2 pacientes en el estudio principal.
No hubo casos confirmados de inhibidores del Factor VIII.†
Nuestros cuerpos cuentan con mecanismos conocidos para eliminar el PEG. Se excreta a través de los riñones (por medio de la orina) y el hígado (por medio de las heces).
Se produjeron reacciones alérgicas en 2 pacientes. En 1 paciente, la reacción alérgica se relacionó con el polietilenglicol (PEG), un componente de Jivi.1,4
Jivi está indicado para adolescentes mayores de 12 años y adultos con hemofilia A previamente tratados.1
*En por lo menos el 5 % de los pacientes.1
†En el estudio principal se informó sobre un inhibidor del Factor VIII (1.7 UB/mL) en un sujeto adulto que recibió tratamiento previamente. La repetición de las pruebas no confirmó la presencia del inhibidor del Factor VIII (UB, unidades Bethesda; mL, mililitros).1
Comience de forma simple
DOS VECES POR SEMANA
Para todos los pacientes con profilaxis: El régimen inicial recomendado es Jivi dos veces por semana (30-40 IU/kg)1
Ajuste
CADA 5 DÍAS
Según los episodios de hemorragia: Se puede utilizar una posología menos frecuente de Jivi cada 5 días (45-60 UI/kg)1
Puesta a punto
Según los episodios de hemorragia: La frecuencia de administración puede ajustarse aún más, ya sea para aumentarla o disminuirla1
Border-top Border-bottom
8 de cada 10
redujeron su frecuencia de dosificación en comparación con el régimen profiláctico previo al estudio5*
Comience de forma simple
DOS VECES POR SEMANA
Para todos los pacientes con profilaxis: El régimen inicial recomendado es Jivi dos veces por semana (30-40 IU/kg)1
Ajuste
CADA 5 DÍAS
Según los episodios de hemorragia: Se puede utilizar una posología menos frecuente de Jivi cada 5 días (45-60 UI/kg)1
Puesta a punto
Según los episodios de hemorragia: La frecuencia de administración puede ajustarse aún más, ya sea para aumentarla o disminuirla1
Border-top Border-bottom
8 de cada 10
redujeron su frecuencia de dosificación en comparación con el régimen profiláctico previo al estudio5*
UI, unidades internacionales; kg, kilogramos; rFVIII, Factor VIII recombinante.
*40/47 pacientes en los grupos con dosificación cada 5 días y dos veces por semana de quienes se disponían los registros de dosificación de la profilaxis previa.5
Escuche a Ryan hablar sobre por qué la posología gradual de Jivi se ajusta a su estilo de vida.
INDICACIONES
JIVI es un medicamento inyectable que se utiliza para reemplazar el factor de coagulación (Factor VIII o factor antihemofílico) que no poseen las personas que padecen hemofilia A.
JIVI se utiliza para tratar y controlar las hemorragias en adultos y niños, a partir de los de 7 años de edad, con hemofilia A que recibieron tratamiento previamente. Su proveedor de atención médica también puede administrarle JIVI cuando se somete a una cirugía. JIVI puede reducir la cantidad de episodios de hemorragia en adultos y niños, a partir de los de 7 años de edad, con hemofilia A si se usa de manera regular (profilaxis).
JIVI no está indicado para usar en niños menores de 7 años o en pacientes que no recibieron tratamiento previo.
JIVI no está indicado para tratar la enfermedad de von Willebrand.
INFORMACIÓN DE SEGURIDAD IMPORTANTE
No debe utilizar JIVI si es alérgico a los roedores (como los ratones y hámsteres) o a cualquier ingrediente de JIVI.
JIVI puede provocar reacciones alérgicas. Llame a su proveedor de atención médica de inmediato e interrumpa el tratamiento si presenta opresión en el pecho o la garganta, mareos, disminución en la presión arterial o náusea. Es posible que ocurran reacciones alérgicas al polietilenglicol (PEG), un componente de JIVI.
Su cuerpo también puede fabricar anticuerpos, denominados “inhibidores”, contra JIVI o ciertos componentes de JIVI, como el polietilenglicol (PEG), lo que puede interrumpir la acción adecuada de JIVI. Consulte con su proveedor de atención médica para asegurarse de que será supervisado atentamente mediante análisis de sangre para detectar el desarrollo de inhibidores del Factor VIII. Informe a su proveedor de atención médica si le han informado que tiene inhibidores del Factor VIII.
Si su hemorragia no es controlada con su dosis habitual de JIVI, consulte con su médico de inmediato. Puede haber desarrollado inhibidores del Factor VIII o anticuerpos contra el PEG y su médico puede realizar pruebas para confirmarlo.
Los efectos secundarios frecuentes de JIVI son dolor de cabeza, fiebre, tos y dolor abdominal.
Estos no constituyen todos los posibles efectos secundarios de JIVI. Informe a su proveedor de atención médica acerca de cualquier efecto secundario que le moleste o no desaparezca.
Informe a su proveedor de atención médica sobre todas las enfermedades y/o condiciones médicas que tiene o que tuvo.
Para obtener información adicional importante sobre riesgos y uso, consulte la Información para Prescribir completa.
References: 1. Jivi® Prescribing Information. Whippany, NJ: Bayer LLC; 2018. 2. Data on file. Tx Review 0918. Bayer; 2018. 3. Ratain MJ, Plunkett WK Jr. Principles of pharmacokinetics. In: Kufe DW, Pollock RE, Weichselbaum RR, et al, eds. Holland-Frei Cancer Medicine. 6th ed. Hamilton, Ontario: BC Decker; 2003. 4. Reding MT, Ng HJ, Poulsen LH, et al. Safety and efficacy of BAY 94-9027, a prolonged-half-life factor VIII. J Thromb Haemost. 2017;15(3):411-419. 5. Kerlin BA, Simpson ML, Reding MT, Linardi C, Schwartz L. Comparison of bleeding rates before and during BAY 94-9027 prophylaxis: data from the PROTECT VIII study and extension. Presented at: 4th Biennial Summit of the Thrombosis & Hemostasis Societies of North America; March 8-10, 2018; San Diego, CA. 6. Veronese FM, Mero A. The impact of PEGylation on biological therapies. BioDrugs. 2008;22(5):315-329. 7. Reding M, et al. Haemophilia. 2021; 10.1111/hae.14297. 8. Data on file. CSR PH 40454. BAY 94-9027/13024. 9. Reding MT et al. Haemophilia. 2020;26(4):e201-e204. 10. Reding M et al. Poster P29. Presented at the Hemostasis and Thrombosis Research Society 2019 Scientific Symposium. 9–11 May 2019, New Orleans, Louisiana. 11. Data on file. CSR 2.5. Bayer, 2018. 12. Data on file. Jivi PROTECT VIII Extension AUG 2019 CSR Target Joint Analysis data; Bayer.